在生物藥物研發生產過程中,質量管理與控制是至關重要的一環。
耀海生物秉持以“質量為本、完善合規、簡單高效、團結協作”的質量方針為指引,將質量管理視為公司的生命線,建立了符合NMPA、FDA、EMA等法規要求的質量管理體系,并在不斷的創新發展過程中,持續完善和提升質量管理體系。堅持以確保產品質量為目標,以客戶滿意為宗旨,致力于為廣大合作伙伴提供符合FDA、EMA、NMPA的IND和臨床階段樣品制備,及滿足NMPA商業化階段的藥品生產的全方位質量管理服務。
耀海生物擁有符合GMP規范的大規模生物藥商業化生產基地,于2012年取得治療用生物制品的藥品生產許可證,并多次通過國家藥監局藥品注冊現場核查和GMP符合性檢查。經藥監部門審核通過的質量管理體系,貫穿從研發到商業化階段的全流程。
耀海生物質量管理體系建立原則
?質量體系覆蓋藥品從研制至商業化生產的全生命周期。
?質量體系基于國內外現行的法律法規,遵循CMC(化學,生產與控制)活動的法律法規要求。
?結合CRDMO業務特點,靈活滿足客戶對藥品委托研究和委托生產的需求。
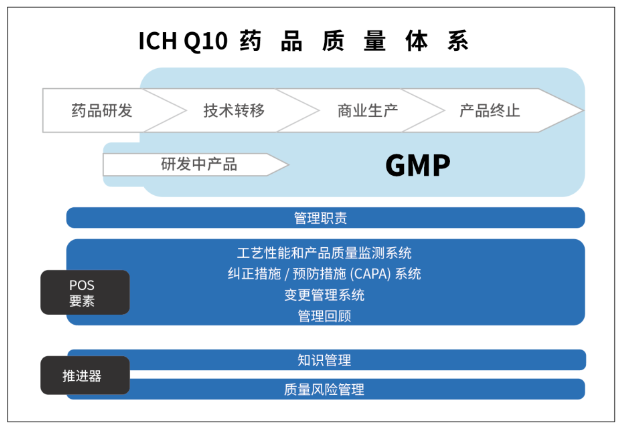
Q10藥品全生命周期質量管理
文件保障系統
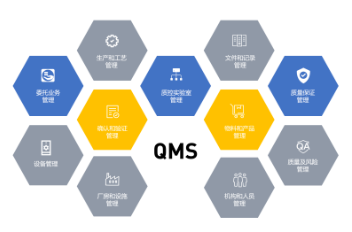
耀海生物依據GMP相關要求,建立了完備的文件保障系統,同時緊貼公司業務模式,確保公司所有的GMP活動均在文件體系規范下進行,保證生產過程的均一性、可復制性和可追溯性。
耀海生物擁有1500平方米的獨立QC實驗室,基于自身豐富的GMP質量管理經驗,通過質量控制(QC)團隊與生產、質量保證團隊密切合作,不斷提升在生物藥原輔料檢測、中間過程控制、穩定性研究及產品放行檢測等方面服務能力,旨在為客戶提供持續穩定的質量服務。同時,建立了完善的質量控制體系,符合各法規要求,質量體系貫穿QC檢驗各階段。

目前,公司建立了完善的理化、微生物學、生物化學方面的質量檢測平臺,可根據產品的不同理化特性,建立了針對不同產品的質量控制方法。憑借豐富的實驗室品質管理經驗及分析檢測能力,匹配行業一流的檢測設備,能夠滿足生物制品(重組蛋白、多肽類、質粒產品等)放行檢測要求,支持生物藥開發全生命周期的分析與質控需求。
憑借豐富的實踐經驗和日臻完善的質量管理服務體系,耀海生物已成功賦能兩百余個客戶項目,贏得客戶廣泛贊譽,在CRDMO服務行業內堅定了堅實的服務口碑。

未來,耀海生物將繼續堅持以客戶滿意為目標,秉承“質量為本、完善合規、簡單高效、團結協作”的質量方針,通過持續的監控、回顧、定期更新來不斷完善質量管理體系,以滿足客戶對商業化生產的高期望,靈活應對客戶對臨床階段cGMP合規性的需求,向客戶提供卓越的服務和可信賴的產品質量,為藥品研發生產保駕護航。